2024.11.20
【プレスリリース】水素イオンの流れを使ってATP合成酵素が回転する仕組みを解明!創薬ターゲットタンパク質であるATP合成酵素の解明によって将来的な医薬応用への波及にも期待
本件のポイント
- ATP合成酵素による ATP合成機構の解明は、数十年の長きにわたり研究されてきた重要な生命科学の課題の一つです。本研究により、水素イオンの流れによる回転機構が明らかになり、ATP合成機構の解明に必要な重要なピースの一つが埋まりました。本研究で用いた好熱菌由来ATP合成酵素は、ミトコンドリアにあるATP合成酵素とまったく同じものではありませんが、基本的な部分の構造は共通であり、今回の知見はミトコンドリアにあるATP合成酵素にも当てはまると考えています。
- ATPは、生命にとって最も重要なエネルギー物質であり、細胞のミトコンドリアに存在するATP合成酵素という巨大なタンパク質によって合成されます。この酵素は、生体膜を横断する水素イオンの流れを回転力に変換し、その力でATPを生成しますが、これまで水素イオンの流れがどのようにしてATP合成酵素を回転させるのか、その詳細な分子メカニズムは不明でした。
- 今回の研究で得た研究手法を、我々の細胞にあるミトコンドリアの ATP合成酵素の研究に適応し、糖尿病などの代謝やミトコンドリア異常が原因である疾病の治療につながる知見を得ていきます。
概要
京都産業大学生命科学部 横山 謙 教授、西田結衣さん(修士課程2年生)、京都工芸繊維大学応用生物学系 岸川 淳一 准教授、自然科学研究機構分子科学研究所/総合研究大学院大学 岡崎 圭一 准教授らのグループは、1)クライオ電子顕微鏡法と2)分子動力学シミュレーションを用いて、好熱菌由来3)4)ATP合成酵素の詳細な構造とその回転メカニズムを明らかにしました。
ATP(アデノシン三リン酸)は、生命にとって最も重要なエネルギー物質であり、細胞のミトコンドリアに存在するATP合成酵素という巨大なタンパク質によって合成されます。この酵素は、生体膜を横断する水素イオンの流れを回転力に変換し、その力でATPを生成します。これまで、水素イオンの流れがどのようにしてATP合成酵素を回転させるのか、その詳細な分子メカニズムは不明でした。しかし、本研究では、ATP合成酵素の回転力を発生させる膜内在部分(Vo部分)の詳細な構造をクライオ電子顕微鏡で解明し、回転力発生に重要な役割を果たすアミノ酸残基の向きを特定しました。さらに、Vo部分の構造を基に分子動力学シミュレーションを行い、水素イオンの流れによる回転メカニズムを解析しました。その結果、回転リングにある特定のアミノ酸残基の荷電状態の変化が回転力発生に重要であることがわかりました。ATP合成酵素は、ヒトから細菌に至る幅広い生物界に存在するタンパク質です。本研究で特定されたアミノ酸残基はすべてのATP合成酵素にほぼ保存されており、この発見は生命がATPを合成する最も重要な仕組みの解明に貢献するものです。
本成果は、2024年11月20日(水)19:00(日本時間)に国際学術誌 『Nature Communications』 にてオンライン掲載されます。
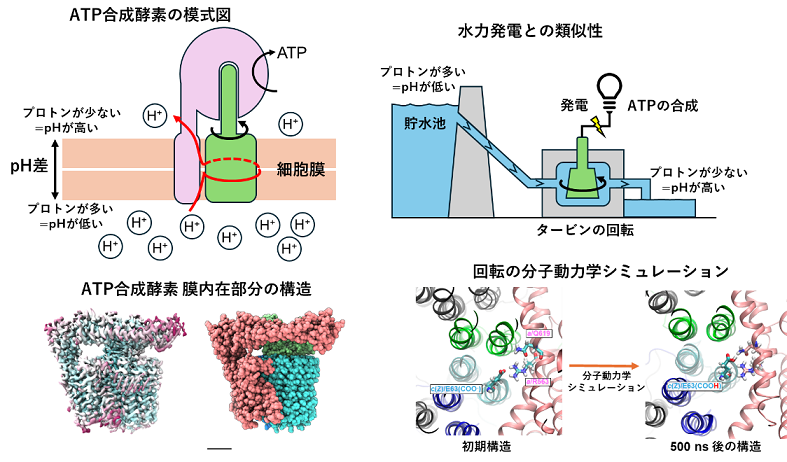
背景
ATPは、生命のエネルギー通貨として生体内の様々な反応を進める重要な分子です。我々の細胞では、炭水化物や脂肪が細胞内で分解されると、ミトコンドリア内膜を横断して水素イオンを移動させるプロトン駆動力が発生し、これを使って ATP合成酵素がATPを合成します。 ATP合成酵素は、膜に埋まった膜内在性部分と膜から突き出た親水性部分からなります(図2)。膜内在性部分では、プロトン駆動力による水素イオンの移動により、リング構造が分子内部で回転し、親水性部分の軸部分がつられて回転することによりATPが合成されます(図2AB)。親水性部分でのATP合成反応の詳細については、これまでの研究によりほぼ解明されている一方で、膜内在性部分での水素イオンの流れによる回転機構は、その詳細な構造が不明なこともあり、未解決の課題として残されていました。本研究では、膜内在性部分における水素イオンの流れによる回転機構の解明を目的として、ATP合成酵素の膜内在性部分の詳細な構造を決定し、その構造情報に基づいた分子動力学シミュレーションを行いました。
研究手法・成果
本研究では、5)好熱菌Thermus thermophilus 由来のATP合成酵素を材料として、クライオ電子顕微鏡法によって、その構造を原子レベルで明らかにしました。クライオ電子顕微鏡法は、6)膜タンパク質の構造決定法として非常に強力な技術であり、ATP合成酵素などの多くの膜タンパク質の構造決定に利用されています。ATP合成酵素全体の構造は、親水性部分と膜内在性部分が相対的に動くため、高分解能の構造を得ることは困難です。本研究では、AT合成酵素全体に加え、膜内在性部分だけを取り出して、その構造解析を行いました。
今回、私達は単離した膜内在性部分の構造を7)最大分解能2.8 Å で決定しました(図1)。その結果、膜内在性部分のaサブユニットとc12リングの間の親水的な隙間に複数の水分子を同定することができました(図2C)。水分子は、プロトンを輸送するうえで道筋となる重要な分子です。また、プロトンを輸送するために重要なc12リングのアミノ酸残基(63番目のグルタミン酸/E63)が、プロトンの結合状態によって向きがことなることを確認しました(図2D)。特に、親水的な隙間に存在している3つのE63は、水素イオンを離した電離状態になっており、真ん中の E63(c(Z))が a サブユニットのアルギニン残基と静電的に強く結合していることが確認されました。(図2D c(Y)、c(Z)、c(O))。そこで、その3つのE63の電離状態に着目し、分子動力学シミュレーションにより、3つのE63の電離状態が回転に及ぼす影響を検証しました。c(Z)のE63 を水素イオンが結合した状態にすると、シミュレーション中でc12リングがaサブユニットに対して、約10°回転しました(図3)。また、c(Z)のE63に水素イオンが結合しない状態で、c12リングを強制回転させると、リングと a サブユニット間の相互作用が強くなりスムーズにリングが回転しないことが示されました(図3)。また、c(Z)をはさむc(Y)、c(O)のE63のプロトン結合状態も回転に影響することもわかりました。これらの結果から、リングに存在する3つのE63 の荷電状態が水素イオンの流れによって不均一になり、そのためリングのブラウン運動の方向に偏りができ、リングが一方向に回転することが示唆されました(図4)。
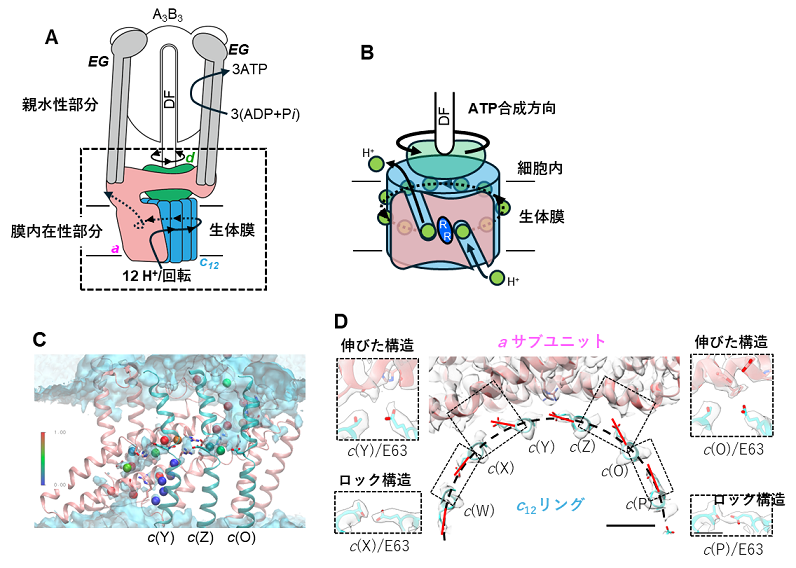
図2.好熱菌由来ATP合成酵素の立体構造。(A)好熱菌由来ATP合成酵素の模式図。親水性部分と膜内在性部分からなる。膜内在性部分は、a サブユニット、c12,リング、d サブユニット、EG サブユニットからなる。a サブユニットに対して、c12リング・d サブユニット・DFサブユニットの複合体が回転する。回転に伴い、親水性部分でATPが合成酵素される。(B)膜内在性部分の模式図。a サブユニットには細胞内、細胞外に開いたハーフチャネルが開いており、ハーフチャネルを介して、プロトンの結合と解離が起こる。中央にあるRは、アルギニン残基でハーフチャネルが繋がらないようにバリアとして働く。(C)同定した水分子を球で示した。球の色は、分子動力学シミュレーションによる存在確率の高さを示す(赤(高)←→(低)青)。(D)c12リングのE63 の向き。a サブユニットに面した2つのE63(c(Y)、c(O))の向きが、c12リングの円周に対し外側を向いている。
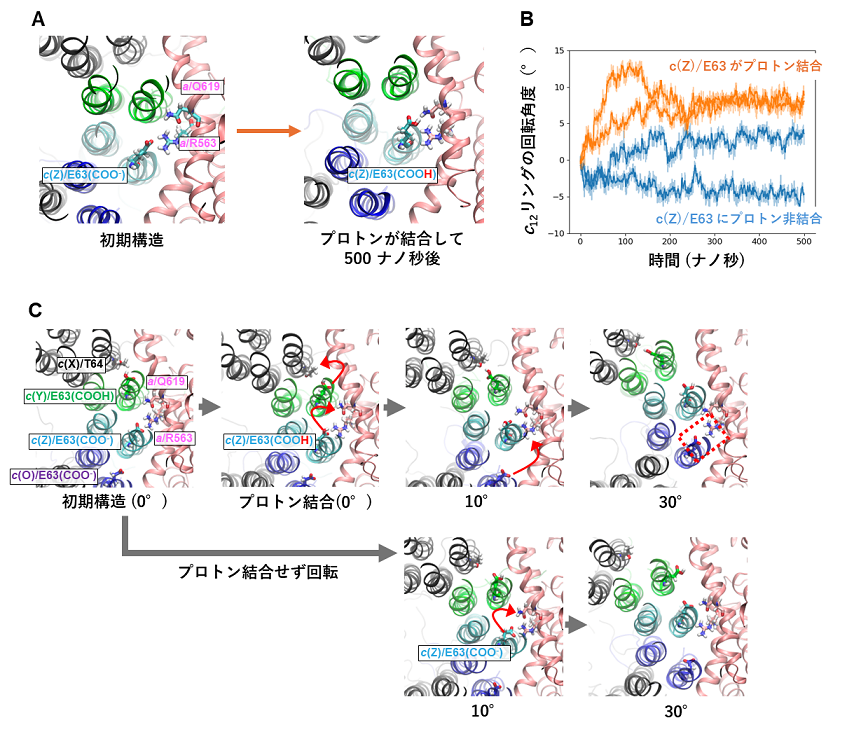
図3.分子動力学シミュレーションによるc12リングのE63のプロトン結合状態の回転への影響。(A)c(Z)/E63にプロトン結合させ、シミュレーションを行うと、約10°回転した。(B)c(Z)/E63のプロトン結合状態の違いによる回転の違い。プロトン結合状態では約10°回転する(オレンジ)が、非結合状態ではほとんど回転しない。(C)シミュレーション上で、c12リングを強制的に回転させ、c(Z)/E63のプロトン結合状態の違いによる影響を観察した。プロトン結合条件では、アミノ酸残基の相互作用相手が順番に変わり、スムーズに回転する(赤矢印)。プロトンが結合していない状態では、相互作用相手を変えることができず、30°回転させるとc12リングが歪んでしまった。
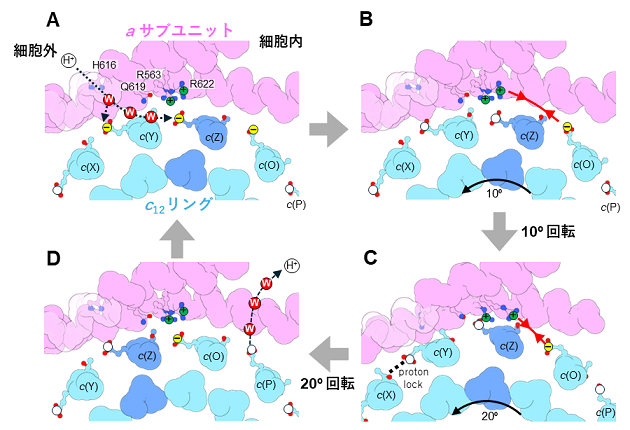
図4.ATP合成酵素の回転の分子メカニズム。a サブユニットとc12リングの界面の拡大図を示す。c12リングのE63を、白丸と黄丸でしめす。白丸はプロトンが結合しており、電気的に中性、黄丸はプロトンが結合しておらず、電気的にマイナスの電荷を持つ。(A)水分子を介して、E63が細胞外からプロトンを受け取ることで、プロトン結合状態になる。(B)プロトンが結合することで、プラスの荷電を持つアルギニンとの結合が弱まり、10°回転する。(C)マイナスの電荷を持つc(O)/E63がアルギニンに近づくことでお互いに引き合い、更に20°回転する。(D)c(P)/E63からプロトンが解離することで、マイナスの電荷を持つ。次にc(O)/E63が細胞外からプロトンを受け取る。このように連続的にプロトンの受け渡しが行われることで、回転が生み出される。
波及効果・今後の予定
ATP合成酵素による ATP合成機構の解明は、数十年の長きにわたり研究されてきた重要な生命科学の課題の一つです。今回の研究により、水素イオンの流れによる回転機構が明らかになり、ATP合成機構の解明に必要な重要なピースの一つが埋まりました。本研究でもちいた好熱菌由来ATP合成酵素はミトコンドリアにあるATP合成酵素とまったく同じものではありませんが、基本的な部分の構造は共通であり、今回の知見はミトコンドリアにあるATP合成酵素にも当てはまると考えています。多くの生物の生存に欠かせないATP合成酵素は、代謝や疾病にも関係する重要な創薬ターゲットタンパク質であり、その分子機構と詳細な構造解明は、将来的な医薬応用にも繋がります。今後は、今回の研究で得た研究手法を、我々の細胞にあるミトコンドリアの ATP合成酵素の研究に適応し、糖尿病などの代謝やミトコンドリア異常が原因である疾病の治療につながる知見を得ていきます。
研究プロジェクトについて
本研究は、文部科学省科学研究費助成事業(23H02453 [横山]、 20K06514 [岸川]、 22H02595 [岡崎])、武田科学振興財団 [横山]、AMED研究事業 (BINDS) JP17am0101001、 文部科学省ナノテクプラットフォーム事業、 科学技術振興機構 戦略的創造研究推進事業(CREST) (JPMJCR1865 [光岡])の支援を受けて行われました。
用語解説
1) クライオ電子顕微鏡法 (cryo electron microscopy):急速凍結したタンパク質などの生体試料に電子線を照射し、試料の観察を行うために透過電子顕微鏡を行う。得られた2次元像から画像解析により、3次元再構成を行い、生体分子の立体構造を決定する。
2) 分子動力学シミュレーション (Molecular dynamics simulation): タンパク質の動きを計算する手法の1つ。タンパク質分子を原子レベルでコンピュータの中に再現し、原子間・分子間の相互作用に拘束を与えることで、タンパク質の動きを再現する。シミュレーションの細かさによって、QM/MM、全原子、粗視化などがある。
3) ATP (adenosine triphosphate): 様々な生体反応にエネルギー源として使われるため、細胞のエネルギー通貨とも呼ばれる。ヒトをはじめ多くの生物では、ATP合成のほとんどはATP合成酵素によって担われている。
4) ATP合成酵素 (ATP synthase): ATPの合成を担うタンパク質。真核生物の場合、ミトコンドリア内膜、細菌の場合は細胞膜に存在する。膜に埋まった部分で、生体膜内外に形成されたpH差を回転に変換し、膜から突き出た部分で回転力を使ってATPを合成する(図1)。回転によって反応を行うため、回転分子モーターとも呼ばれる。
5) 好熱菌 Thermus thermophilus: 静岡県伊豆の温泉で発見された至適生育温度が約75℃の好気性細菌。本菌由来のタンパク質は、熱耐性が高く、安定なため、構造解析に向いている。
6) 膜タンパク質 (Membrane proteins): その一部、または全体が生体膜の中に埋まっているタンパク質。細胞内外の情報伝達や物質の輸送などに関わる。タンパク質全体の約3割が膜タンパク質である。
7) 分解能(Resolution)、Å: 分解能は、2つの点が2つの点として区別できる解像度を言う。数字が小さいほど、より高解像度の立体構造であることを示す。Åは、100 億分の1 メートル。構造解析分野において、解像度を示す単位として用いられる。
論文タイトルと著者
研究に関するお問い合わせ先
- 岸川 淳一(きしかわ じゅんいち)【筆頭著者】
京都工芸繊維大学・准教授
TEL: 075-724‐7532
E-mail: [email protected] - 岡崎 圭一(おかざき けいいち)【責任著者】
自然科学研究機構分子科学研究所/総合研究大学院大学・准教授
TEL: 0564-55-7468
E-mail: [email protected] - 横山 謙(よこやま けん)【責任著者】
京都産業大学生命科学部・教授
TEL: 075-705-3043
E-mail: [email protected]
取材に関するお問い合わせ
- 京都工芸繊維大学 総務企画課広報係
TEL: 075-724-7016
E-mail: [email protected] - 自然科学研究機構分子科学研究所 広報担当
TEL: 0564-55-7209
E-mail: [email protected] - 京都産業大学 広報部
TEL: 075-705-1411
E-mail: [email protected] - 総合研究大学院大学 広報社会連携係
TEL: 046-858-1629
E-mail: [email protected]
